Calcul du potentiel des cellules
-
?Un Ancien Utilisateur dernière édition par
Bonjour,
Je me permets de vous solliciter pour obtenir de l'aide sur un exercice.énoncé:
Les chercheurs ont découverts une nouvelle forme de vie qui serait extraterrestre. La découverte met en évidence que ces créatures sont ressemblant aux formes de vie terrestres: organisés en cellules avec des potentiels électriques existant le long des membranes de certaines cellules excitables. Néanmoins leur chimie est légèrement différente.
Ce tableau répertorie les concentrations des principaux ions trouvés dans les milieux intra et extra cellulaire ainsi que le perméabilité des membranes cellulaires à chacun des ions.
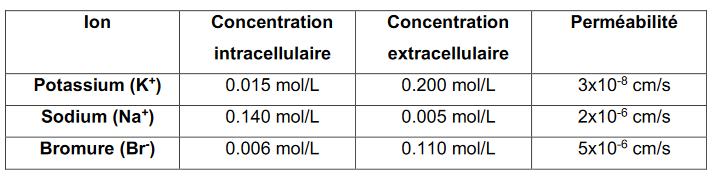
- Il faut trouver en calculant le potentiel transmembranaire au repos des cellules extraterrestres.
--> Après des recherches sur le Web je suis tombé sur ce document:
http://unf3s.cerimes.fr/media/paces/Grenoble_1112/villa_alessandro/villa_alessandro_p03/villa_alessandro_p03.pdf
page 11, le problème c'est que rien ne fait mention de perméabilité et que je pense qu'il ne faut pas juste faire une soustractionJe vous remercie par avance
Bon après-midi
-
@anesthesiste Bonjour,
Tu n'as pas dans le cours une définition de potentiel transmembranaire ?
-
?Un Ancien Utilisateur dernière édition par
Bonjour @Noemi ,
Non malheureusement rien
-
@anesthesiste
Donc utilise les indications du document mais il te manque des données, par exemple la température .
-
?Un Ancien Utilisateur dernière édition par
@Noemi
Je viens de trouver ça dans mon cours de la semaine prochaine:
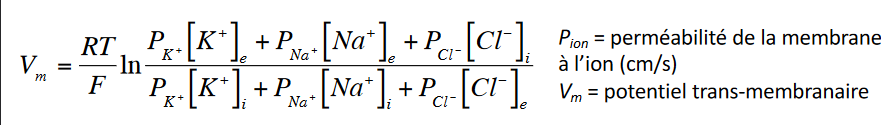
Concernant la température et après réflexion ne faudrait-il pas partir sur sur 37°C soit 310°K qui est la température du corps humain vu que " La découverte met en évidence que ces créatures sont ressemblant aux formes de vie terrestres"?
-
@anesthesiste
Donc utilise cette formule.
-
?Un Ancien Utilisateur dernière édition par
@Noemi concernant la température êtes vous d'accord?
-
@anesthesiste
Tu indiques que tu fais le calcul avec cette température.
-
?Un Ancien Utilisateur dernière édition par
Merci beaucoup
-
?Un Ancien Utilisateur dernière édition par
Après calcul et sauf erreur je trouve comme résultat -0.077 V
-
@anesthesiste
Vérifie le calcul, je trouve -0,03355 V
-
?Un Ancien Utilisateur dernière édition par
J'ai vérifié toutes les valeurs et j'ai refait le calcul et je retombe sur le même résultat
-
@anesthesiste
Peux-tu écrire le calcul ?
-
?Un Ancien Utilisateur dernière édition par
je n'arrive pas à l'écrire

-
@anesthesiste
Tu es sur que c'est des logarithmes népériens dans la formule et pas des logarithmes décimaux ?
J'ai fait le calcul avec des logarithmes décimaux.
-
?Un Ancien Utilisateur dernière édition par
Je pense car sur la formule il y a ln et j'ai un exemple (avec des valeurs différentes) mais quand je refais le calcul avec ln je retombe sur le même résultat
-
@anesthesiste
Donc utilise ln. Ta réponse est alors correcte.
-
?Un Ancien Utilisateur dernière édition par
Merci @Noemi
J'ai aussi une autre question qui me pose problème concernant l'écriture des réaction chimique (quelque chose que j'ai toujours eu du mal)
La question est: Les chercheurs utilisent des électrodes de type Ag/AgBr, composée d'une base en argent notée Ag et recouverte de bromure d'argent noté AgBr qui est un sel très peu soluble dans l'eau.
Ecrire la réaction chimique qui domine à l'interface avec une de ces électrodes à un instant donné où le courant électrique conventionnel circule de l'appareil de mesure vers le sujet. De plus s'agit-il d'une oxydation ou d'une réduction?Comment dois-je procéder?
Merci par avance
-
@anesthesiste
AgBrAgBrAgBr + e−e^-e− donne AgAgAg + Br−Br^-Br−
-
?Un Ancien Utilisateur dernière édition par
Le problème c'est que je ne suis jamais arrivé à comprendre ces notions.
La preuve je ne comprends pas du tout comment trouver les formules que vous donnez et principalement la première
-
@anesthesiste
Pour les équations :
AgBrAgBrAgBr →\xrightarrow{} Ag+Ag^+Ag+ + Br−Br^-Br−
Ag+Ag^+Ag+ + e−e^-e− →\xrightarrow{} AgAgAg
-
?Un Ancien Utilisateur dernière édition par
Bonjour @Noemi,
Malheureusement c'est encore très flou.
Je vais essayer de reprendre chronologiquement:Mes électrodes sont composées de deux parties Ag et AgBr
J'ai un tableau dans mon cours indiquant "metal and reaction": Ag --> Ag+ + e-
donc la j'ai l'équation de la première partie de mon électrode?
Après pour la seconde partie AgBr je n'ai rien dans le tableau.
Comment je sais que pour Ag il faut mettre un + et non un -? (pareil pour Br)
-
@anesthesiste
Pour reconnaître un ion positif ou négatif, il faut utiliser la classification périodique ou la structure électronique de l'atome.
-
?Un Ancien Utilisateur dernière édition par
Ce type de tableau?
Mais comment savoir + ou - car ce n'est pas indiqué ?
-
@anesthesiste
En partant de la gauche,
La première colonne, les atomes ont un seul électron sur la dernière couche électronique donc ils peuvent perdent cet électron, ils deviennent alors chargé positivement.
Soit Li+Li^+Li+, Na+Na^+Na+, K+K^+K+, ....
La deuxième colonne, les atomes ont deux électrons sur la dernière couche électronique donc ils peuvent perdent ces 2 électrons, ils deviennent alors chargé positivement.
Soit Be2+Be^{2+}Be2+, Mg2+Mg^{2+}Mg2+, Ca2+Ca^{2+}Ca2+, ....La onzième colonne, ces atomes peuvent eux aussi perdre un électron.
Cu+Cu^{+}Cu+, Ag+Ag^{+}Ag+,Les éléments de l'avant dernière colonne peuvent gagner un électron car il manque un électron sur leur dernière couche.
F−F^{-}F−, Cl−Cl^{-}Cl−, Br−Br^{-}Br−,Les éléments sur l'avant avant dernière colonne peuvent gagner deux électrons.
O2−O^{2-}O2−, S2−S^{2-}S2−.
-
?Un Ancien Utilisateur dernière édition par Un Ancien Utilisateur
En faisant une généralité tout ce qui est à gauche à le signe +
et tout ce qui est a droite à le signe -Donc maintenant je comprends que:
Ag --> Ag+
Br --> Br-Comment sait-on qu'il faut un plus entre Ag+ et Br-
Après avoir cette première équation comment dois-je faire pour obtenir la seconde?
-
@anesthesiste
Une équation doit être équilibrée.
Vu que tu as un seul même atome à gauche et à droite, il te reste à équilibrer l'équation au niveau de la charge. Il doit y avoir le même niveau de charge à droite et à gauche. Tu ajoutes seulement des électrons : e−e^-e−.
Cela donne :
AgAgAg →\rightarrow{}→ Ag+Ag^+Ag+ + e−e^-e− l'atome d'argent perd un électron.
BrBrBr + e−e^-e− →\rightarrow{}→ Br−Br^-Br− l'atome de brome gagne un électron.
-
?Un Ancien Utilisateur dernière édition par
Merci @Noemi ça commence à devenir clair.
Donc Ag perd un électron donc Ag+ e-
Br gagne un électron donc Br- + e-Ici on est sur une électrode Ag/AgBr dois-je remplacer Ag par l'expression trouvée précédemment? idem pour Br?
-
@anesthesiste
Des deux équations tu peux écrire :
AgBrAgBrAgBr →\xrightarrow{} Ag+Ag^+Ag+ + Br−Br^-Br−
Pour la question, il est indiqué une circulation d'électrons donc au départ :
AgBrAgBrAgBr + e−e^-e−
d'ou l'équation :
AgBrAgBrAgBr + e−e^-e− →\xrightarrow{} AgAgAg + Br−Br^-Br−
-
?Un Ancien Utilisateur dernière édition par
Mais ce que j'ai du mal a comprendre c'est que l'équation Ag+ + Br- correspond à AgBr mais où est passé Ag de Ag/AgBr?
-
@anesthesiste
C'est le couple AgAgAg, AgBrAgBrAgBr
Dans l'équation finale, tu as les deux éléments.
-
?Un Ancien Utilisateur dernière édition par
Très bien je vois.
Les e- disparaissent car ils se compensent?
-
@anesthesiste
Il reste un e−e^-e− dans la dernière équation.
-
?Un Ancien Utilisateur dernière édition par
Je ne comprends vraiment pas désolé.
Ma compréhension s'est arrêtée après AgBr --> Ag+ + Br-D'où sort ce e- ?
-
@anesthesiste
AgBrAgBrAgBr →\xrightarrow{} Ag+Ag^+Ag+ + Br−Br^-Br−
Pour la question, il est indiqué une circulation d'électrons donc au départ :
AgBrAgBrAgBr + e−e^-e−
d'ou l'équation :
AgBrAgBrAgBr + e−e^-e− →\xrightarrow{} Ag+Ag^+Ag+ + Br−Br^-Br− + e−e^-e−
et Ag+Ag^+Ag+ + e−e^-e− →\xrightarrow{} AgAgAg
alors
AgBrAgBrAgBr + e−e^-e− →\xrightarrow{} AgAgAg + Br−Br^-Br−
-
?Un Ancien Utilisateur dernière édition par
Alors effectivement l'énoncé stipule qu'il y a un courant electrique conventionnel qui circule.
Donc cela signifie qu'on ajoute e- à AgBr.Après AgBr +e-:
AgBr --> Ag+ + Br- et pour équilibrer on ajoute des e- des deux côtés, c'est bien ça?@Noemi a dit dans Calcul du potentiel des cellules :
@anesthesiste
AgBrAgBrAgBr + e−e^-e− →\xrightarrow{} Ag+Ag^+Ag+ + Br−Br^-Br− + e−e^-e−
et Ag+Ag^+Ag+ + e−e^-e− →\xrightarrow{} AgAgAgLa première correspond à AgBr(../AgBr)
et la seconde a Ag(Ag/...)
-
@anesthesiste
la première équation correspond à Ag/AgBrAg/AgBrAg/AgBr
La deuxième à Ag/Ag+Ag/Ag^+Ag/Ag+
-
?Un Ancien Utilisateur dernière édition par
Vous n'êtes pas aidé avec moi désolé.
Ok pour la première équation.
Par contre la seconde Ag/Ag+ n'est pas mentionné dans l'énoncé comment puis je savoir?
-
@anesthesiste
La deuxième équation te permet de comprendre la première. La première est la réponse à la question.
-
?Un Ancien Utilisateur dernière édition par
Merci @Noemi je reprends tout ça demain.
Merci encore
-
?Un Ancien Utilisateur dernière édition par
Bonjour @Noemi,
Je pense avoir compris. La seconde equation permet de simplifier la première car Ag+ + e- = Ag donc on peut faire le remplacement dans la première équation.Par contre je suis perdu sur la seconde étape où il faut dire si cette réaction chimique est une oxydation ou une réduction en expliquant brièvement la démarche.
J'ai regardé plusieurs vidéos sur youtube mais c'est très très abstrait.
Ce que je pense avoir compris c'est qu'il faut réutiliser le précédent résultat: AgBr + e- --> Ag + Br-
Après j'ai cru comprendre qu'il fallait déterminer si il y avait une perte ou un gain d'électrons mais je ne sais pas comment faire
-
@anesthesiste
Un schéma à connaître
A tout couple oxydant réducteur, on associe une demi équation de la forme :Oxydant + ne−e^-e− →reˊduction\xrightarrow{réduction}reˊduction Réducteur
Oxydant + ne−e^-e− ←oxydation\xleftarrow{oxydation}oxydation Réducteur
ou
Réducteur →oxydation\xrightarrow{oxydation}oxydation Oxydant + ne−e^-e−
-
?Un Ancien Utilisateur dernière édition par Un Ancien Utilisateur
Oui j'ai vu ça sur les vidéos que j'ai regardé.
Mais Comment savoir si AgBr est Oxydant ou réducteur?
Edit: Pour moi Br est oxydant car il està droite du tableau périodique.
Par contre pour Ag je ne sais pas car il est au milieu
-
@anesthesiste
Tu analyses l'équation bilan :
AgBrAgBrAgBr + e−e^-e− →\xrightarrow{} AgAgAg + Br−Br^-Br−
Ici c'est une réduction car :
AgBrAgBrAgBr qui est l'oxydant capte des électrons
et AgAgAg est le réducteur.
-
?Un Ancien Utilisateur dernière édition par Un Ancien Utilisateur
Mais qu'est ce qui nous dit que AgBr est l'oxydant et Ag le réducteur?
Personnellement je ne le vois pasParce que AgBr on a 2 éléments en 1. Br est oxydant mais comment savoir oxydant * Ag c'est toujours oxydant?
-
@anesthesiste
Regarde de quel côté est l'électron e−e^-e−.
-
?Un Ancien Utilisateur dernière édition par
@Noemi
e- est à gauche de l'équation
-
@anesthesiste
e−e^-e− est associé à l'oxydant.
-
?Un Ancien Utilisateur dernière édition par
@Noemi a dit dans Calcul du potentiel des cellules :
@anesthesiste
Un schéma à connaître
A tout couple oxydant réducteur, on associe une demi équation de la forme :Oxydant + ne−e^-e− →reˊduction\xrightarrow{réduction}reˊduction Réducteur
Oxydant + ne−e^-e− ←oxydation\xleftarrow{oxydation}oxydation Réducteur
Mais dans le schéma ci-dessous il est à gauche est pourtant ca peut être une réduction et une oxydation.
Sauf si et comme vous dite e- est associé dans les deux cas à l'oxydant ce qui permet d'affirmer que AgBr est donc l'oxydant mais une fois qu'on connait cet élément qu'est ce qui permet de savoir si on est face à une réduction ou une oxydation?
-
@anesthesiste
L'oxydation correspond à une perte d'électrons,
une réduction correspond à un gain d'électron.Dans l'exercice, c'est le générateur qui permet la circulation des électrons, donc un apport d'électrons à l'électrode, d'ou une réduction.
-
?Un Ancien Utilisateur dernière édition par
Donc si je comprends bien
AgBr + e+e^+e+ →reˊduction\xrightarrow{réduction}reˊduction Ag + Br−Br^-Br−
Par contre le sujet ne fait pas mention de générateur, c'est implicite?
-
@anesthesiste
Oui.
-
?Un Ancien Utilisateur dernière édition par
Donc quand on me demande d'expliquer brièvement la démarche suivie, il faut:
-Que je rappelle le schéma oxydant-réducteur.
-Que je dise que AgBr est l'oxydant car il y a le e-
-Qu'il y a un générateur qui permet la circulation des électrons ce qui signifie que des électrons sont ajoutés. L'ajout d'électrons correspond au phénomène de réduction.Que pourrais-je rajouter pour affirmer qu'il s'agit d'une réduction?
-
@anesthesiste
L'écriture de l'équation de la réaction est suffisant pour indiquée que c'est une réduction.
Le schéma correspond au cours donc justifie.
-
?Un Ancien Utilisateur dernière édition par
Merci Noemi
Pour être sur d'avoir tout bien compris dans la première partie quand on avait Ag /AgBr le premier Ag n'a pas été pris en compte car il était déjà présent dans l'équation de AgBr
Dans la seconde partie vous m'avez dit qu'on avait un générateur, la notion étant implicite. Mais si ce n'est pas clairement indiqué cela signifie que dans n'importe quel cas il y a un générateur. Or si j'ai bien compris votre explication à chaque fois qu'il y a un générateur cela signifie qu'il y a un apport d'électrons et donc qu'il y a une réduction
-
@anesthesiste
Lors de l'écriture de l'équation : AgAgAg et AgBrAgBrAgBr apparaissent donc on ne peut pas dire que AgAgAg n'est pas pris en compte.
L'énoncé indique que l'on branche un appareil de mesure donc on crée un circuit électrique avec déplacement d'électrons.
-
?Un Ancien Utilisateur dernière édition par
Merci @Noemi
Oui pour la première je voulais dire ne pas re-compter Ag pour ne pas faire doublon.
Pour la seconde Ok je n'avais pas compris que c'était l'instrument de mesure le générateur.En tout cas merci pour votre patience.
-
?Un Ancien Utilisateur dernière édition par
Ce message a été supprimé !