Chimie Réactions Acides Bases
-
Ppouvens dernière édition par
Bonjour pouvez -vous m'aidez svp ?
Dans cette section, nous ferons l’hypothèse que le laboratoire
pharmaceutique a donné une indication correcte donc chaque
comprimé contient 500 mg de principe actif, l’acide
acétylsalicylique C9H8O4 notée A. Néanmoins un comprimé
comprend également des excipients si bien qu’un comprimé
pèse environs 600 mg.On rappelle : 𝑝𝐾𝑎
(𝐶9𝐻8𝑂4 𝐶9𝐻7𝑂4− ⁄ ) = 3,5 et
𝑀𝐶9𝐻8𝑂4 = 180,15 𝑔. 𝑚𝑜𝑙−1
Question : En prélevant 100 mg de comprimé, quel est
la quantité de matière 𝑛𝐴 ? Après dissolution dans 100 mL d’eau,
quelle est la concentration molaire 𝐶𝐴 𝑡ℎ ?Q2. Après dilution de 5 mL de NaOH à 0,2 mol.L-1 dans un volume total de 100 mL, calculez la concentration 𝐶𝐵 de votre solution titrante.
Q3. Ecrire l’équation de dosage entre le réactif à titré C9H8O4 et le réactif titrant OH-
. A l’aide d’une échelle d’acidité, déterminer la constante d’équilibre K de cette réaction dans le sens direct. En déduire le caractère total ou non de la réaction.Q.4 Déterminer le volume équivalent théorique noté Veq th en mL.
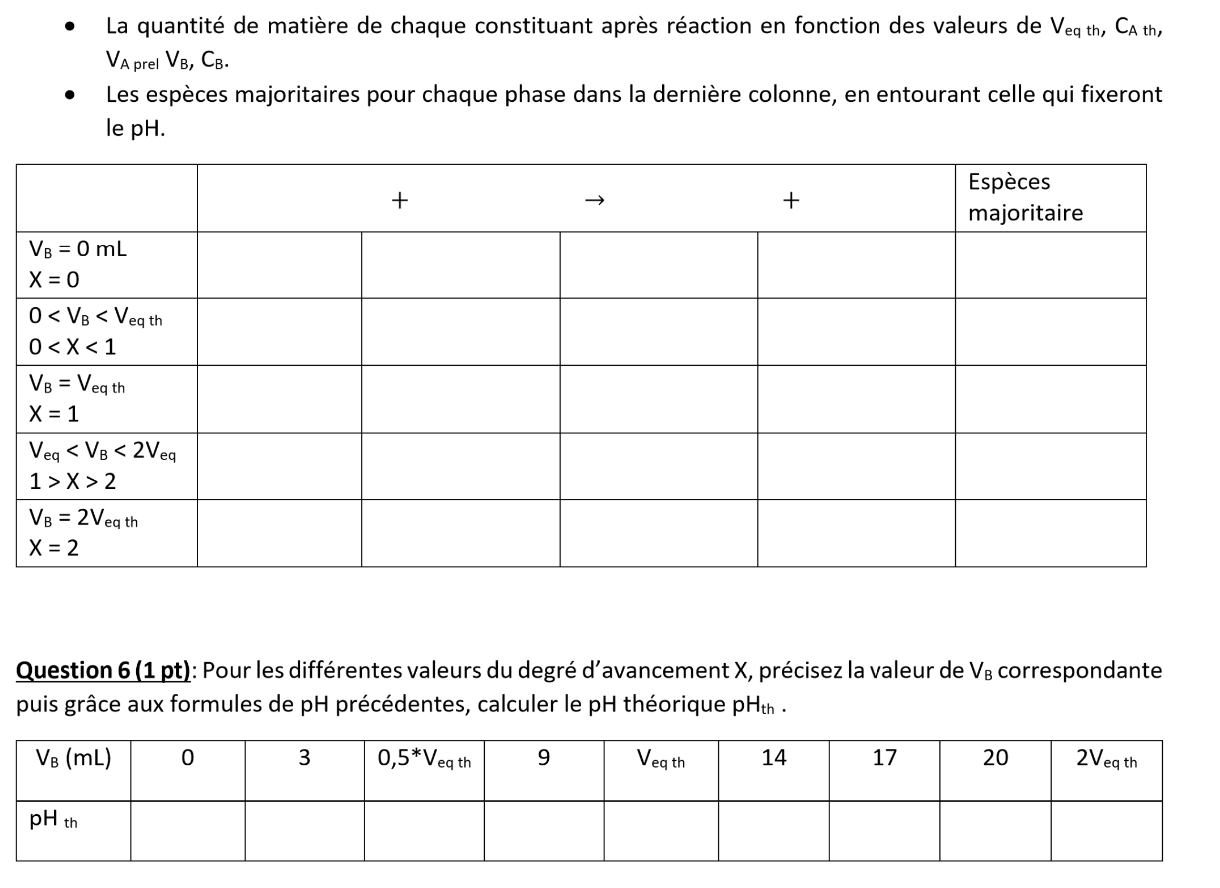
Q5 Remplir le tableau d’avancement suivant en quantité de matière en précisant :
• La quantité de matière de chaque constituant après réaction en fonction des valeurs de Veq th, CA th,
VA prel VB, CB.
• Les espèces majoritaires pour chaque phase dans la dernière colonne, en entourant celle qui fixeront le pHQ.6 : Pour les différentes valeurs du degré d’avancement X, précisez la valeur de VB correspondante puis grâce aux formules de pH précédentes, calculer le pH théorique pHth
-
@pouvens Bonsoir,
Indique tes éléments de réponse et la question qui te pose problème.
-
Ppouvens dernière édition par
Merci pour votre réponse

je suis pas sur que c'est bon et je bloque à partir de la Q4
-
Ppouvens dernière édition par
pour Veq j ai trouvé 55.5mL
CxV=VeqxCb
-
Ppouvens dernière édition par
Du coup c'est la 5 et la 6 oú je comprends pas
-
Ppouvens dernière édition par
@Noemi ?
-
BBlack-Jack dernière édition par
Bonjour,
Il y a déjà un soucis à ta première réponse (je n'ai pas lu la suite).
1 comprimé de 600 mg contient 500 mg de principe actif.
Donc 100 mg de comprimé contient 500/6 mg de principe actif
Avec M(A) = 180,15 g/mol ---> nA = (500/6)*10^-3/180,15 = 4,63.10^-4 mol
-
Ppouvens dernière édition par
merci beaucoup pour la réponse mais Je n'ai pas compris .
-
Ppouvens dernière édition par
@Black-Jack pourquoi on divise par 6?
Du coup la quitte est fausse ?
-
Ppouvens dernière édition par
@Black-Jack a dit dans Chimie Réactions Acides Bases :
4,63.10^-4 mol
Je pense avoir compris.
Du coup la concentration est de 4,63x10^-3 mol.L-1
-
Ppouvens dernière édition par
@Black-Jack Vous pouvez vérifier la suite svp et m'aider pour la 5 et 6.
Merci beaucoup
-
BBlack-Jack dernière édition par
@pouvens a dit dans Chimie Réactions Acides Bases :
@Black-Jack a dit dans Chimie Réactions Acides Bases :
4,63.10^-4 mol
Je pense avoir compris.
Du coup la concentration est de 4,63x10^-3 mol.L-1Oui,
Pour moi ta réponse à la question 2 est correcte et l'équation dans la question 3 aussi.Pour le reste, il vaudrait mieux attendre l'avis d'une personne compétente en chimie ... donc pas moi (la Physique, sans problème, mais la chimie ...)
-
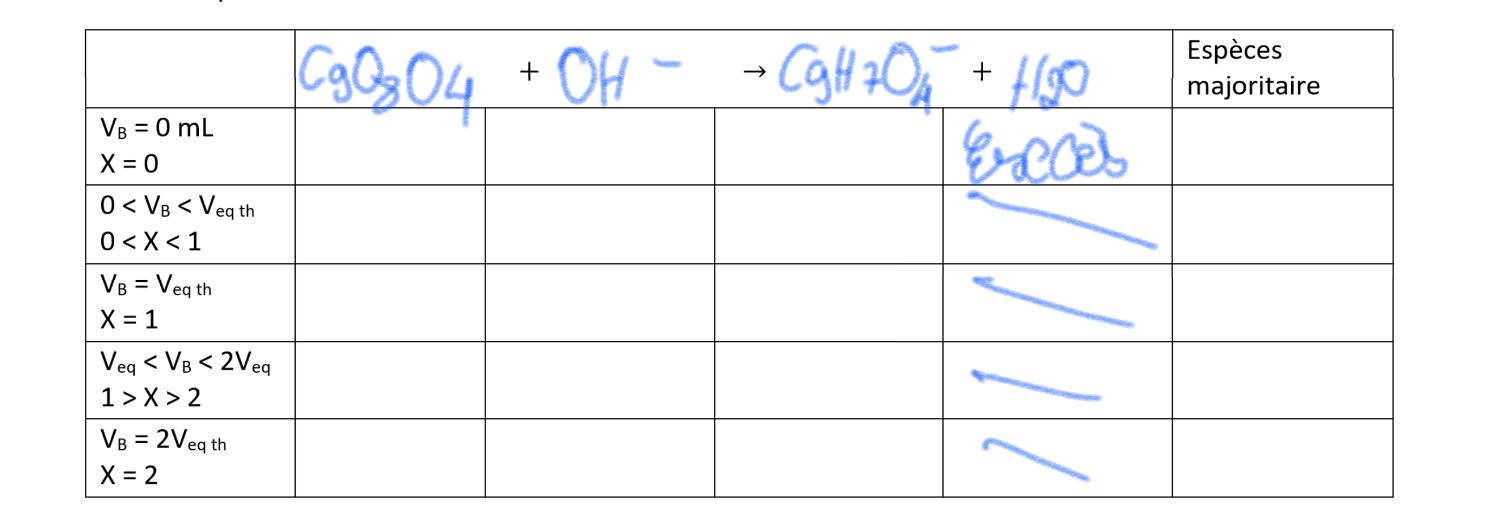
Complète le tableau en partant de l'équation du dosage.
-
Ppouvens dernière édition par
je comprend pas le tableau
-
Pour la deuxième ligne, C'est avant le dosage donc volume de l'acide VAV_AVA et volume de la base 0,
pour la deuxième ligne : On a versé un volume xxx de base, donc
Volume de l'acide VA−xV_A-xVA−x, ....
-
Ppouvens dernière édition par
